Siguiente: Otras máquinas térmicas Subir: Procesos reversibles y trabajo Anterior: Rendimiento de máquinas
|
Las máquinas de Carnot son máquinas cíclicas ideales que se han estudiado siempre con asiduidad debido a su relevancia histórica, pero sobre todo porque ayudan a comprender mejor ciertos aspectos importantes de la termodinámica.
Estas máquinas constan de dos reservorios de calor a temperaturas
|
|
El primer proceso se inicia en el estado ![]() y consiste de una expansión
isotérmica en contacto con el reservorio a
y consiste de una expansión
isotérmica en contacto con el reservorio a ![]() hasta llegar al estado
hasta llegar al estado
![]() ; durante esta expansión se absorbe una cantidad de calor
; durante esta expansión se absorbe una cantidad de calor ![]() . A
continuación se aisla térmicamente el sistema para realizar una expansión
adiabática hasta el estado
. A
continuación se aisla térmicamente el sistema para realizar una expansión
adiabática hasta el estado ![]() . Luego se comprime el sistema hasta el estado
. Luego se comprime el sistema hasta el estado
![]() , manteniéndolo en contacto con el reservorio a
, manteniéndolo en contacto con el reservorio a ![]() , de manera que se
entrega al mismo una cantidad de calor
, de manera que se
entrega al mismo una cantidad de calor ![]() . El último proceso de cada
ciclo se realiza aislando nuevamente el sistema, compriméndolo hasta
retornar al estado inicial
. El último proceso de cada
ciclo se realiza aislando nuevamente el sistema, compriméndolo hasta
retornar al estado inicial ![]() .
.
| Las máquinas de Carnot no necesariamente utilizan un gas como sistema
auxiliar. En el caso general se tiene una variable intensiva
|
|
entonces que el sentido de los ciclos en los diagramas debe ser opuesto, ya que el trabajo realizado por el sistema en ambos casos debe ser positivo.
|
Es frecuente también representar el ciclo de Carnot en el plano
|
|
En cualquiera de estas representaciones puede verse que
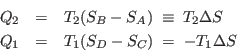
Las máquinas de Carnot son las máquinas térmicas más eficientes que pueden operar entre dos temperaturas determinadas (¡en particular porque son reversibles!). Este resultado se había analizado en cursos anteriores: si existiera una máquina térmica más eficiente que la de Carnot podría utilizársela en conjunción con esta última operada en sentido inverso; el trabajo producido por la máquina super-eficiente puede emplearse para operar la de Carnot, haciendo fluir calor de una fuente fría a una fuente caliente como único resultado de nuestro proceso, violando así uno de los enunciados de la segunda ley de la termodinámica.
Vale la pena notar que las máquinas reales nunca alcanzan la eficiencia termodinámica ideal, valiendo en los casos más favorables un 40% de ésta. Sin embargo, el valor de la eficiencia ideal se utiliza habitualmente como referencia en el diseño de motores.
Vemos que las máquinas de Carnot proveen un medio para medir la temperatura.
Hasta el momento sólo la habíamos definido como la derivada de una función
abstracta, la entropía. Ahora podemos utilizar el hecho de que
De la misma manera pueden medirse diferencias de entropía, lo cual dejaría
indeterminada una constante aditiva para ![]() ; no obstante, teniendo en
cuenta el postulado de Nernst, los respectivos valores quedan completamente
determinados, ya que para
; no obstante, teniendo en
cuenta el postulado de Nernst, los respectivos valores quedan completamente
determinados, ya que para ![]() debe valer
debe valer ![]() .
.
Gustavo Castellano 12/06/2018