Práctico de Laboratorio N
Objetivo:
Construcción de la curva de calibración del espectroscopio
y medición de las longitudes de onda de algunos espectros
característicos.
Introducción:
Se acepta que los posibles estados de los electrones en los átomos
están cuantizados; es decir, que sus energías sólo pueden
tomar determinados valores discretos. Por los tanto, todo cambio
en la energía de los átomos se realizará mediante la
absorción o emisión de cantidades discretas de energía
electromagnética, la cual estará caracterizada por la
frecuencia ![]() según la relación
según la relación
![]() ,
donde
,
donde ![]() es la constante universal de Planck.
Teniendo en cuenta que
es la constante universal de Planck.
Teniendo en cuenta que
![]() , los procesos atómicos
(debido a las transiciones electrónicas) estarán caracterizados
por la absorción o emisión de radiación electromagnética
con longitudes de onda
, los procesos atómicos
(debido a las transiciones electrónicas) estarán caracterizados
por la absorción o emisión de radiación electromagnética
con longitudes de onda ![]() definidas y características
del particular elemento químico que se considere.
definidas y características
del particular elemento químico que se considere.
Resulta así que los gases monoatómicos exitados emiten espectros de líneas; esto es, un conjunto discreto de radiaciones monocromáticas. De los vapores moleculares se obtienen espectros de bandas, es decir espectros contínuos a trozos, según se observa en instrumentos de baja resolución. Por otro lado, en los sólidos calentados hasta la incandescencia (como el filamento de tungsteno de las lámparas comunes), se observa un espectro contínuo en el cual están presentes todas las longitudes de onda visibles, aunque no necesariamente con igual intensidad. Para el caso del espectro solar, y en general para la luz proveniente de cualquier estrella, se observa un espectro de absorción, es decir, el espectro contínuo con algunas longitudes de onda ausentes, las cuales corresponden a las líneas características los elementos presentes en la atmósfera estelar (fotósfera).
El método óptico más antiguo para el estudio de los espectros corresponde a la dispersión de la luz con un prisma. El espectroscopio consta esencialmente de un prisma y dos tubos (ver Figura 1): un colimador (C) por el cual llega la luz de la fuente a observar al prisma, y un ocular (O) por donde se observa el espectro refractado por el prisma.
El colimador tiene una ranura delgada de abertura regulable, colocada en el plano focal de la lente de entrada, de modo que el prima es iluminado por un haz paralelo. Cada componente monocromática es desviada por el prisma un ángulo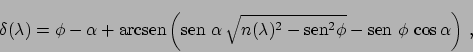 |
(1) |
Para poder referenciar las distintas imágenes de color observadas,
el espectroscopio suele tener un tercer tubo, el cual proyecta una
escala transparente sobre una cara del prisma la cual por
reflexión se superpone con la imagen del espectro en el ocular.
Un vez fijada la posición de la escala con respecto al colimador,
las diferentes divisiones de la escala (en principio arbitrarias)
se corresponderan con valores definidos de ![]() . Entonces,
observando espectros conocidos se puede trazar la curva de
calibración del espectroscopio, la cual indica para cada
división de la escala la longitud de onda correspondiente.
. Entonces,
observando espectros conocidos se puede trazar la curva de
calibración del espectroscopio, la cual indica para cada
división de la escala la longitud de onda correspondiente.
Usualmente en los espectroscopio el prisma está ubicado en la
posición correspondiente al ángulo de desviación mínima
para la luz de sodio.
Desarrollo Experimental: Describir con detalle el espectroscopio utilizado, señalando el procedimiento empleado para su uso: disposición de los tubos y lámparas espectrales, abertura de la rendija de entrada, iluminación de la escala, etc.
Utilizar como fuentes espectrales tubos de Plücker, que consisten
en tubos cerrados con gas del elemento de interés a presión del
orden de ![]() mm de mercurio. Los electrodos de los extremos se
conectan al secundario de una bobina de inducción, cuya descarga
eléctrica exita al gas, el cual así emite luz. Este método
de generación de espectros se llama de luminiscencia.
mm de mercurio. Los electrodos de los extremos se
conectan al secundario de una bobina de inducción, cuya descarga
eléctrica exita al gas, el cual así emite luz. Este método
de generación de espectros se llama de luminiscencia.
Experiencia 1: Calibración de la Escala
Emplear al menos dos tubos de Plücker correspondientes a elementos
cuyos espectros son conocidos (por ejemplo Hg y He) para calibrar la
escala. Anotar el color de cada una de las líneas visualizadas,
la longitud de onda correspondiente según valores de tabla
y la división de la escala bajo la cual se observa.
Con todas las líneas registradas confeccionar la tabla
y la correspondiente curva de calibración (![]() vs. div.
de escala). Discutir el error de la calibración (posiblemente
dividiendo en segmentos la curva de calibraión).
vs. div.
de escala). Discutir el error de la calibración (posiblemente
dividiendo en segmentos la curva de calibraión).
Experiencia 2: Determinación de elementos a partir de su espectro
Emplear al menos otros dos tubos de Plücker diferentes a los
empleados en la calibración para observar las líneas de
emisión y determinatr sus respectivas longitudes de onda utilizando
la escala calibrada. Comparar las longitudes de onda medidas con
valores de tabla.
Experiencia 3: Espectro de un tubo fluorescente
Utilizar como fuente de luz un tubo fluorescente. El espectro de estos tubos es contínuo y es generado por la pintura fluorescente que recubre el interior del tubo. Esta pintura absorbe la radiación ultravioleta emitida por el vapor encerrado en el tubo y la devuelve en parte como radiación visible y parte en forma de calor. Superpuesto con el espectro contínuo se destacan algunas líneas espectrales visibles más brillantes que corresponden tambien a los elementos del vapor encerrado. Medir las longitudes de onda de estas líneas y por comparación con valores de tabla averiguar que elemento predomina en el gas del tubo.
Tener en cuenta que algunas líneas espectrales no serán
observadas por ser de baja intensidad, y no tener en consecuencia
suficiente contraste con respecto al espectro contínuo observado.
Además pueden aparecer otras líneas, correspondientes
a las asociaciones atómicas o iónicas, que no se encontrarán
en las tablas elementales.
Experiencia 4: Espectro solar o de Fraunhofer
La observación sólo puede hacerse los días luminosos, con el
espectroscopio junto a una ventana y con la rendija de entrada muy
cerrada, procurando no apuntar nunca directamente al sol.
Requiere acostumbramiento previo para observar bajo esas condiciones.
Registrar todas las líneas ausentes y calcular sus respectivas
longitudes de onda. Con la ayuda de tablas, identificar los elementos
que contribuyeron al espectro de absorción.
Bibliografía:
J. S. Fernández y E. Galloni, Trabajos Prácticos de Física, ``La Linea Recta'', Buenos Aires (1963).