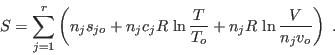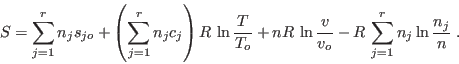El último término de esta expresión se denomina entropía de mezcla, y
es mayor que 0, ya que 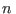 es mayor que cada uno de los es mayor que cada uno de los 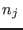 (¡salvo
cuando (¡salvo
cuando 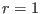 !). Para comprender mejor su significado, conviene notar que se
ha expresado la entropía como la suma de términos que dependen de !). Para comprender mejor su significado, conviene notar que se
ha expresado la entropía como la suma de términos que dependen de
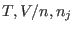 más el término que llamamos entropía de mezcla. Puede pensarse
que los primeros términos corresponden a la composición de más el término que llamamos entropía de mezcla. Puede pensarse
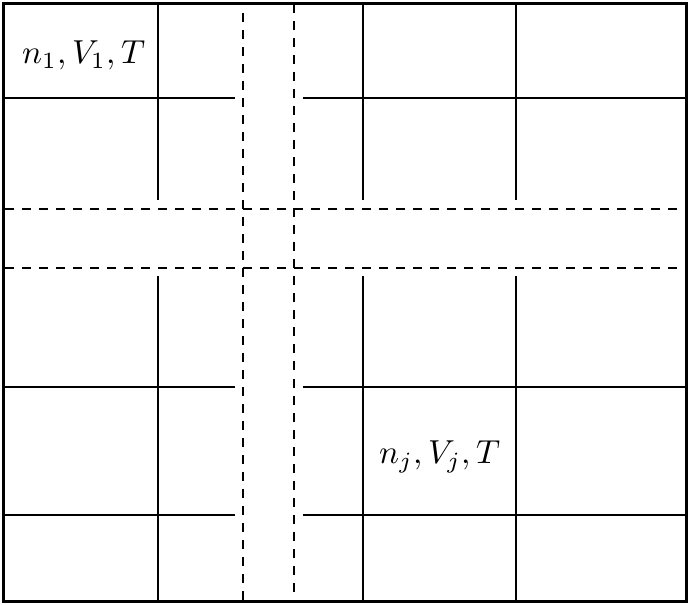
que los primeros términos corresponden a la composición de 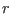 recipientes
distintos, donde el recipientes
distintos, donde el 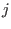 -ésimo recipiente contiene gas de tipo -ésimo recipiente contiene gas de tipo 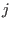 puro a temperatura puro a temperatura 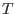 , en un volumen , en un volumen
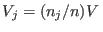 (de manera que (de manera que
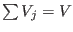 ). De este modo todos los volúmenes molares ). De este modo todos los volúmenes molares 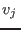 son iguales
al volumen molar son iguales
al volumen molar 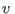 que resulta de mezclar los distintos componentes, ya
que que resulta de mezclar los distintos componentes, ya
que 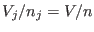 . En la situación inicial, la entropía sólo debe incluir
los primeros términos, y cuando se permite que los gases se mezclen,
aparece el último término, que justamente indica el aumento de la entropía
por tener los gases mezclados. . En la situación inicial, la entropía sólo debe incluir
los primeros términos, y cuando se permite que los gases se mezclen,
aparece el último término, que justamente indica el aumento de la entropía
por tener los gases mezclados.
|
|
![]() para reescribir la entropía de un gas ideal monocomponente en
términos de
para reescribir la entropía de un gas ideal monocomponente en
términos de ![]() :
: