Siguiente: Ecuación de Euler y Subir: Condiciones para el equilibrio Anterior: Equilibrio respecto del flujo
Un análisis muy parecido al anterior se aplica cuando ocurren reacciones
químicas.En éstas los números de moles de los componentes van
cambiando: algunos crecen a expensas de que otros vayan disminuyendo. Estas
relaciones se escriben mediante ecuaciones del tipo
Cuando un proceso químico ocurre en una vasija cerrada y adiabática, una vez alcanzado el equilibrio termodinámico la entropía debe haber llegado a un máximo: las variaciones infinitesimales de la entropía son
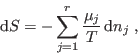
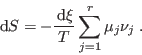
![\begin{displaymath}
{\fbox{ $\displaystyle \sum_{j=1}^r \mu_j \nu_j =
0\rule[-1.75em]{0em}{4em}$ } }
\end{displaymath}](img160.png)
En un ejemplo más completo que los anteriores, consideramos el caso en que
![]() y
y ![]() se introducen en nuestra vasija
cerrada y aislada. Las reacciones que pueden ocurrir en este caso son tres:
se introducen en nuestra vasija
cerrada y aislada. Las reacciones que pueden ocurrir en este caso son tres:
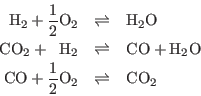
Entonces en el equilibrio debe cumplirse:
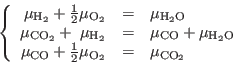
Éstas son dos ecuaciones independientes (la primera es la suma
de las otras dos). Junto con las cantidades iniciales de H![]() , O
, O![]() y
CO
y
CO![]() se tienen 5 condiciones para los 5 números de moles finales
correspondientes al H
se tienen 5 condiciones para los 5 números de moles finales
correspondientes al H![]() , O
, O![]() , H
, H![]() O, CO
O, CO![]() y CO.
y CO.
Vale la pena destacar que no siempre se fijan ![]() y
y ![]() en una reacción,
sino que a menudo suelen controlarse
en una reacción,
sino que a menudo suelen controlarse ![]() y
y ![]() . Bajo esas condiciones
desarrollaremos más adelante algunas ideas sobre estabilidad respecto de las
reacciones químicas.
. Bajo esas condiciones
desarrollaremos más adelante algunas ideas sobre estabilidad respecto de las
reacciones químicas.
Gustavo Castellano 12/06/2018