Siguiente: Descripción cuántica Subir: Sistemas cerrados Anterior: Descripción clásica
En esta sección analizaremos una propiedad importante de sistemas clásicos para los cuales el hamiltoniano es cuadrático en cada variable del espacio de las fases. Denotando como
![]() a las componentes de
a las componentes de
![]() que intervienen en el hamiltoniano (pueden ser solo algunas de ellas), podemos expresar
que intervienen en el hamiltoniano (pueden ser solo algunas de ellas), podemos expresar
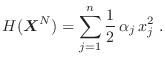
El teorema de equipartición de la energía puede enunciarse de la siguiente manera:
![\fbox{\rule[-2em]{0em}{4.5em}\rule{1.5em}{0em}
\parbox{15cm}{\sl Cada grado de ...
...laystyle \frac12 kT$, sin importar
cuánto vale $\alpha_j$.}\rule{1.5em}{0em}}](img549.png)
En otras palabras,
![]() , es decir la energía está igualmente distribuida en cada grado de libertad, y es proporcional a la temperatura. La demostración del teorema es muy sencilla, ya que la función partición se escribe como
, es decir la energía está igualmente distribuida en cada grado de libertad, y es proporcional a la temperatura. La demostración del teorema es muy sencilla, ya que la función partición se escribe como
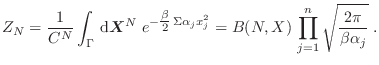
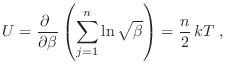
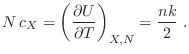
Para considerar algunos ejemplos sencillos, recurrimos primero al caso del gas ideal, cuyo hamiltoniano involucra los ![]() impulsos lineales. Se deja como ejercicio ver que la función partición resulta
impulsos lineales. Se deja como ejercicio ver que la función partición resulta
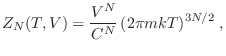

En el caso de moléculas diatómicas clásicas, a los grados de libertad traslacionales deben agregarse las rotaciones, que a temperatura ambiente están presentes y pueden ser descriptas clásicamente. El hamiltoniano clásico suma entonces dos términos cuadráticos a cada molécula, que involucran los impulsos generalizados correspondientes a las dos coordenadas angulares que determinan la orientación de la molécula. La energía interna agrega ahora la contribución de estos ![]() términos, de modo que
términos, de modo que
![]() . Cuando además se activan los modos vibracionales, en el hamiltoniano se incorporan dos términos cuadráticos por molécula, pues las oscilaciones pueden separarse del movimiento del centro de masa mediante la coordenada relativa y el impulso generalizado correspondiente. De este modo, la energía interna resulta en este caso igual a
. Cuando además se activan los modos vibracionales, en el hamiltoniano se incorporan dos términos cuadráticos por molécula, pues las oscilaciones pueden separarse del movimiento del centro de masa mediante la coordenada relativa y el impulso generalizado correspondiente. De este modo, la energía interna resulta en este caso igual a ![]() .
.
Gustavo Castellano 19/11/2021