Producción de radionucleidos¶
Origen¶
Se estima que protones y neutrones fueron condensados en los primeros segundos posteriores al Big Bang y, una vez que la temperatura fue decreciendo producto de la expansión del universo, se crearon los primeros elementos como deuterio y el helio. Por millones de años el universo estuvo compuesto por un plasma compuesto por iones de hidrógeno, deuterio, helio y electrones libres, y al seguir enfriándose los electrones lograron formar núcleos estables con los iones, quedando una gran nube de gas de hidrógeno y helio.
Por gravedad, ese gas neutro se fue acumulando para formar estrellas. A medida de que las estrellas se volvieron más densas y calientes, se favoreció el proceso de fusión, formándose los elementos más pesados que hoy conocemos en la tabla periódica. Entonces, el hidrógeno funcionó como combustible de estrellas y, al acabarse, explotaron desparramando los elementos pesados formados por todo el universo. Estos elementos han generado formaciones rocosas que, por acción de la gravedad, han formado sistemas junto a otras estrellas. Desde la formación del planeta tierra hace 4,5 millones de años, desde en tonces la mayoría de los nucleidos se han transformado en más estables. Solo algunos sobreviven, debido a su larga vida media (\(^{40}\text{K}\), \(^{204}\text{Pb}\) y \(^{232}\text{Th}\) por ejemplo).
En 1896 Henri Becquerel descubre los átomos radiactivos, siendo Marie Curie y su esposo quienes generaron los más importantes avances y aportes al entendimiento de la radiactividad y de las sustancias radiactivas. Al ver que muchos de estos radionucleidos decaen en emisores de tiempos de vida cortos, es que se descubre la posibilidad de darles aplicación en lo que hoy se conoce como medicina nuclear. Este uso práctico de los radionucleidos fue demostrado por George De Heavesy al utilizar un isótopo radiactico del plomo (\(^{210}\text{Pb}\)) como trazador cuando estudiaba la solubilidad de sales de plomo. De Heavesy y sus colegas fueron también quienes utilizaron por primera vez un radiotrazador en un sistema biológico cuando estudiaba la captación de plomo en plantas en 1923, usando \(^{212}\text{Pb}\). Pero el primer estudio clínico lo realizaron Blumengarten and Weiss en 1924 al inyectar \(^{212}\text{Bi}\) en el brazo de un paciente y medir el tiempo que demoraba en llegar al otro brazo, descubriendo que el tiempo aumentaba en paciente con enfermedades cardiológicas.
Radiactividad inducida¶
Al principio, solo los emisores naturales eran conocidos, por lo que no existían radionucleidos de Z bajo. Los experimentos de Rutherford de bombardeo de hojas de oro con partículas \(\alpha\) demostraron la existencia de un nucleo de protones con electrones orbitando alrededor como si fuesen planetas del sistema solar. Pero estudios similares de Irène Curie (hija de Marie) y su marido vieron que el bombardeo de hojas de plata con partículas \(\alpha\), creaba un radionucleido \(^{30}\text{P}\) que emitía con una vida media de unos 3 min. Esto se producía por la reacción \(^{27}\text{Al}(\alpha,n)^{30}\text{P}\). De esta forma, Irène sugiere que se pueden crear elementos a partir del bombardeo de otros. Lo cual fue demostrado un año después por Lawrence en Berkley (produjo \(^{13}\text{N}\) bombardeando \(^{12}\text{C}\) con deuterones) y Fermi en Roma.
Fermi, además, se dio cuenta que los neutrones, al no tener carga, eran más faciles de acercar al núcleo y producir una reacción. Construyó una fuente de neutrones sellando gas de \(^{232}\text{Ra}\) con polvo de Be en vidrio. El \(^{232}\text{Ra}\) emitía partículas \(\alpha\) que reaccionaban con el berilio emitiendo neutrones en una reacción de \(^{9}\text{Be}(\alpha,n)^{12}\text{C}\). Fermi y su grupo bombardeó con neutrones rápidos y lentos todos los elementos de la tabla periódica disponibles. Desde hidrógeno a oxígeno no obtuvieron resultados, pero desde el F en adelante bombardearon 60 elementos y encontraron 40 radionucleidos con radiactividad inducida.
Estas investigaciones también mostraron que los elementos más livianos transmutaban a elementos diferentes, mientras que los elementos más pesados generaban raioisótopos del mismo número atómico. De Heavesy comenzó inmediatamente estudios en ratas que demostraron la cinética de elementos vitales como el \(^{32}\text{P}\), mientras que el \(^{128}\text{I}\) se utilizó para tratar enfermedades relacionadas con la tiroides. Fueron estos trabajos los que dieron las bases del uso de radiotrazadores en biología en general y en medicina en particular.
Utilizando un ciclotrón, se pudo producir \(^{11}\text{C}\) y con él estudiar cosas como la fotosíntesis con dióxido de carbono o la inhalación de monóxido de carbono en humanos. Pero este radioisótopo tiene una vida media de 20 min, lo cual dificultó y limitó los estudios. En 1939 se logró el \(^{14}\text{C}\) por medio de la reacción \(^{13}\text{C}(d,p)^{14}\text{C}\), el cual era mucho más útil pero, en ese tiempo, difícil de separar por ser creado a partir de un isótopo del mismo número atómico. Afortunadamente, de forma casual, una botella de nitrato de amonio quedó cerca del blanco en un bombardeo, y se vió que quedaba activada por la reacción \(^{14}\text{N}(n,p)^{14}\text{C}\). En este caso, el bombardeo se hacía con deuterones (neutron-proton) con una energía de ligadura nuclear de 2 MeV. Al impactar con el blanco, se rompía esa ligadura y se liberaba un neutrón que bombardeaba la botella. La nueva solución, con dosis muy bajas de C, permitía separar el nuevo \(^{14}\text{C}\) simplemente inyectando aire para crear dióxido de carbono \(^{14}\text{C}_2\text{O}\). El mismo año, se descubrió el tritio (\(^{3}\text{H}\)) al bombardear agua con deuterones.
Antes de la segunda guerra mundial, no se lograban fuentes con suficiente flujo de neutrones, por lo que la producción de radionucleidos se realizaba principalmente utilizando ciclotrones. Después, con el desarrollo del reactor nuclear, se abrió la posibilidad de generar una gran cantidad de radionucleidos de gran importancia biológica, como el \(^{3}\text{H}\), \(^{14}\text{C}\), \(^{32}\text{P}\) y el \(^{35}\text{S}\), y muchos de gran utilidad clínica como el \(^{60}\text{Co}\) y el \(^{131}\text{I}\), para radioterapia y medicina nuclear respectivamente.
En los últimos años, se ha incrementado el interés del uso de aceleradores para generar radionucleidos, sobre todo por sus facilidades en la clínica. El \(^{111}\text{In}\), el \(^{123}\text{I}\), el \(^{201}\text{Tl}\), el \(^{11}\text{C}\), el \(^{13}\text{N}\), el \(^{15}\text{O}\) y el \(^{18}\text{F}\) son ejemplos de este tipo de producción en ciclotrones.
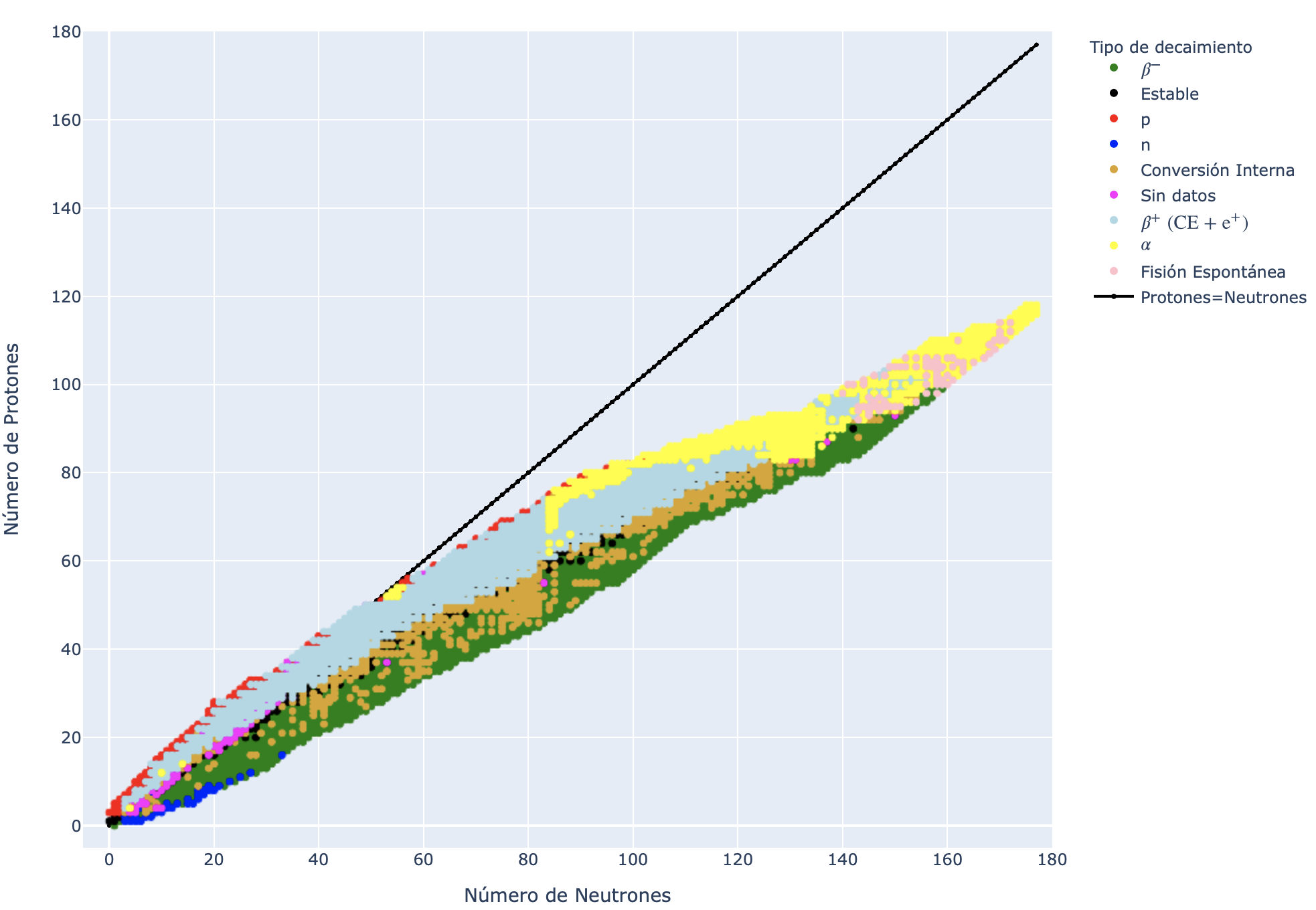
Tabla de nucleidos y línea de estabilidad nuclear¶
Durante el siglo XIX la química organizó los distintos elementos descubiertos según determinadas características físico-químicas, y los ordenó según su número atómico. El descubrimiento de la radiactividad colisionó con esto al presentar elementos del mismo Z y con distintas características físicas (tiempo de vida medio, partícula/energía emitida, etc.). Soddy, en 1913 introdujo el concepto de isótopo (\(\iota\sigma o\int\) = mismo y \(\tau o\pi o\int\) = lugar) pero una interpretación completa de los elementos debió esperar al descubrimiento del neutrón por parte de Chadwick en 1932. El sistema periódico se organizó entonces en función de la cantidad de protones Z, que es la misma cantidad de electrones necesarios para balancear la carga del átomo. Desde entonces, la gráfica de los nucleidos conocidos se construye con el número de neutrones en el eje horizontal y el número de protones en el eje vertical.
Una versión interactiva de la tabla de nucleidos se encuentra disponible en link. En ella se pueden encontrar todos los radionucleidos disponibles en la base de datos Nubase2016 y características físicas de disponibles en la tabla (A, Z, N, tipo de decaimiento principal, vida media, etc.).