Siguiente: Enfriamiento y licuefacción de Subir: Formulaciones alternativas Anterior: Los principios de mínimo
En un sistema gaseoso multicomponente las reacciones químicas ocurren cuando los distintos tipos de moléculas pueden transformarse unos en otros mediante colisiones inelásticas. Para que ocurra una reacción las moléculas deben poseer energía suficiente como para superar las barreras de potencial que existan. El estado de equilibrio químico es estacionario a nivel macroscópico, pero dinámico a nivel molecular, ya que la reacción no se detiene.
Un avance importante para la descripción de las reacciones químicas ha sido
introducido por de Donder a principios del siglo XX: es posible caracterizar
una reacción química mediante una sola variable ![]() , como veremos a
continuación. Para ello consideremos la reacción
, como veremos a
continuación. Para ello consideremos la reacción
Supongamos que inicialmente
![]() moles,
moles,
![]() ,
,
![]() y
y
![]() . La reacción se
``completa'' hacia la derecha cuando
. La reacción se
``completa'' hacia la derecha cuando
Típicamente en una reacción se controlan ![]() y
y ![]() . Éstas son las
variables naturales de la energía libre de Gibbs, de modo que intentaremos
encontrar las condiciones para el equilibrio aplicando el principio de
mínimo para este potencial. A partir de la definición
. Éstas son las
variables naturales de la energía libre de Gibbs, de modo que intentaremos
encontrar las condiciones para el equilibrio aplicando el principio de
mínimo para este potencial. A partir de la definición ![]() , podemos
recordar la relación de Euler para escribir
, podemos
recordar la relación de Euler para escribir
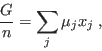
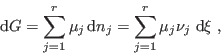
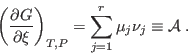
|
En el equilibrio,
En realidad, si en un sistema cerrado
|
|
Como la entalpía está vinculada con el potencial de Gibbs mediante la
relación ![]() , y en virtud de que ahora consideramos como variables
independientes a
, y en virtud de que ahora consideramos como variables
independientes a ![]() ,
, ![]() y
y ![]() , podemos escribir
, podemos escribir
Considerando que
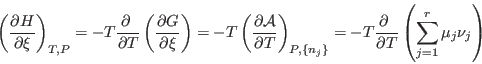
Para el caso concreto de una mezcla de gases ideales (o de una mezcla en la que los ![]() se comportan como los de gases ideales), podemos escribir una expresión cerrada para la afinidad a partir de la expresión correspondiente a la energía libre de Gibbs molar: se deja como ejercicio verificar que la contribución de la componente
se comportan como los de gases ideales), podemos escribir una expresión cerrada para la afinidad a partir de la expresión correspondiente a la energía libre de Gibbs molar: se deja como ejercicio verificar que la contribución de la componente ![]() es
es
![]() , resultando para la afinidad
, resultando para la afinidad
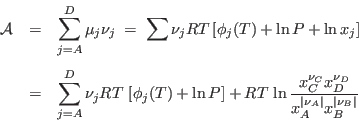
Para un sistema en equilibrio químico a ![]() y
y ![]() fijos, vemos que el cociente
fijos, vemos que el cociente
![]() está completamente determinado por los valores de
está completamente determinado por los valores de ![]() y
y ![]() , ya que
, ya que ![]() debe anularse. Una forma alternativa de expresar la condición anterior para el equilibrio es
debe anularse. Una forma alternativa de expresar la condición anterior para el equilibrio es
![\begin{displaymath}
\ln \left[\frac{x_C^{\nu_C}x_D^{\nu_D}}{x_A^{\vert\nu_A\ver...
...u_B\vert}}
P^{\nu_C+\nu_D+\nu_A+\nu_B}\right] = \ln K(T) \;,
\end{displaymath}](img617.png)
Gustavo Castellano 12/06/2018